Las curvas de enfriamiento son una representación gráfica de la
temperatura (T o Tº) de un material frente al tiempo (t) conforme
este se enfría.
Como se habla de
"enfriamiento", la temperatura debe disminuir mientras el tiempo
avanza por eso se habla de una proporción inversa donde una cantidad disminuye
mientras la otra aumenta.
La transferencia de calor está
relacionada con los cuerpos calientes y fríos llamados; fuente y receptor, en
donde la misma, tiene sus propios mecanismos (conducción, convección y radiación)
y cada uno de ellos cuenta con sus peculiaridades. La transferencia de calor es
importante en los procesos, porque es un tipo de energía que se encuentra en tránsito,
debido a una diferencia de temperaturas (gradiente), y por tanto existe la
posibilidad de presentarse el enfriamiento, sin embargo esta energía en lugar
de perderse sin ningún uso es susceptible de transformarse en energía mecánica
por ejemplo; para producir trabajo, generar vapor, calentar una corriente fría,
etc.
La Figura 1 muestra el diagrama de fases
temperatura-composición a presión constante típico de un sistema de dos
líquidos totalmente miscibles que forman eutéctico simple. Para poder construir
un diagrama de este tipo se utilizan las curvas de enfriamiento de sistemas de
diferente composición.
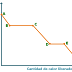
Consideremos lo que sucede al enfriar un líquido puro
(Fig. 2). Para un sistema de un componente puro en la fase líquida, hay un
grado de libertad, la temperatura, y usando la ecuación (2), los grados de
libertad son V = 1, siendo la temperatura la variable que describe el sistema
(porción (a)). Tan pronto coexisten las dos fases (sólido y líquido), P=2 y F=O
y por lo tanto la temperatura es constante (b). Cuando todo el sistema se
convierte en sólido la temperatura vuelve a variar (c). El cambio en pendiente
se debe a la diferencia en la capacidad calorífica del líquido y el sólido.
La Fig. 3 representa la curva de enfriamiento de una
mezcla simple. La solución líquida comienza a enfriarse, disminuyendo su
temperatura a cierta velocidad (d). A cierta temperatura comienza a separarse
un sólido formado por alguno de los componentes puros. El congelamiento es un
fenómeno exotérmico y por eso la velocidad de enfriamiento disminuye (e). A
medida que el sólido se separa, la composición del líquido se hace más rica en
el otro componente y su temperatura de fusión disminuye. Cuando la solución
alcanza una cierta composición (la composición eutéctica) el sistema se congela
como si se tratase de una sustancia pura y la temperatura se mantiene constante
(f).

Fig 4.
Consideremos el diagrama de fases de la Fig. 4. En este
diagrama TA y Tb son las temperaturas de fusión de los sólidos A y B puros. Las
distintas curvas separan las regiones donde el sistema presenta una o más
fases. En la Región I, cualquier punto corresponde al sistema formado por una
solución homogénea. En la región II, un punto corresponde a una situación en la
que el sólido A puro coexiste en equilibrio con una solución líquida de B
disuelto en A. Una situación análoga corresponde a la región III, con el sólido
B en equilibrio con una solución de A disuelto en B. Por debajo de la
temperatura Te, en la región IV, existen los sólidos A y B y no puede
observarse ninguna solución líquida. A la temperatura Te se la llama temperatura eutéctica. Las curvas
“a” y “b” dan la dependencia de la composición de la solución líquida con la
temperatura. En términos generales, estas curvas indican cómo varía la
solubilidad de A en B o B en A en función de la temperatura. En la región I el
número de grados de libertad es 2, por lo tanto, debe especificarse la
temperatura y la composición para definir el estado del sistema. En las demás
regiones, el número de grados de libertad se reduce a 1. Así, los puntos de
diagrama de fases se obtienen preparando mezclas de los dos componentes de
fracciones molares conocidas. Las mezclas se calientan hasta fundirse, se agita
la solución para obtener una solución homogénea y se deja enfriar lentamente.
Mientras la solución se enfría se agita continuamente y se toma la temperatura
como función de tiempo. La región entre a1 y a2 representa el enfriamiento de
la solución. Al llegar a la temperatura T2, se nota un cambio en la pendiente
debido a que a esa temperatura empieza a separarse el sólido A puro. La
precipitación del sólido A libera energía. Esto hace que la mezcla se enfríe más
lentamente que la solución. T2 es el punto de fusión de la solución de
composición x1. De T2 a Te hay una sucesión de equilibrios entre la solución y
el sólido A. La temperatura no se mantiene constante en esta región ya que el
sólido A se está precipitando y la concentración de A en la solución disminuye.
Esto es, la composición de la solución está cambiando entre a2 y a3. A partir
de Te ocurre la precipitación simultánea de dos sólidos separados en fases
diferentes. Una inspección microscópica de ese sólido revela cristales de A
puros mezclados con cristales de B puro. Al llegar a Te la composición de la
solución ha cambiado el máximo permitido para ese sistema binario. La solución
en Te tiene el punto de fusión más bajo posible. A esta temperatura y
composición es donde la fase líquida esta en equilibrio con los sólidos A y B.
A la temperatura Te se le llama la temperatura eutéctica y la composición de la
solución cuyo punto de fusión es Te (el más bajo posible) es la composición
eutéctica. La palabra eutéctica viene del griego que significa "fácilmente
fundible"




No hay comentarios:
Publicar un comentario