Experimento del tapón poroso.
El experimento consiste en dejar fluir un gas desde una presión elevada a otra presión inferior, a través de un tubo que contiene un “estrangulamiento” u obstáculo que puede ser un tapón poroso, una válvula apenas abierta, un orificio muy pequeño, etc. Debido al estrangulamiento, la expansión es muy lenta de tal forma que las presiones a cada lado del obstáculo se mantienen prácticamente constantes.
Se impide el intercambio de calor entre el gas y el medio exterior mediante un aislamiento térmico, de modo tal que el proceso se realice en condiciones adiabáticas.
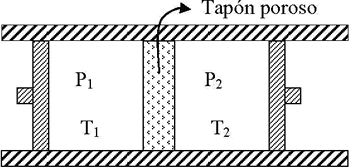
Supongamos, como observamos en la figura, que el gas fluye por un tubo horizontal, aislado adiabáticamente, que contiene un obstáculo. A un lado del obstáculo se mantiene la presión mayor P1, constante mediante una bomba, y al otro lado una presión menor P2. Esta presión P2 en muchos casos puede ser la presión del medio exterior, por ejemplo la presión atmosférica.
Las temperaturas a las presiones P1 y P2 son respectivamente T1 y T2.
Aplicando la ecuación del Primer Principio para sistemas abiertos, que ya vimos en el tema anterior:
Debido a que el gas fluye lentamente ω1 y ω2 son prácticamente nulos, y ω12/2 y ω22/2 ≅ 0. Como el tubo es horizontal h1 ≅ h2. Además, por estar el sistema aislado adiabáticamente,
Q = 0. Por último, no hay trabajo de circulación, Wc= 2
En consecuencia resulta que U1 + P1 . v1 = U2 + P2 . v2 y por definición de entalpía: H1 = H2.
Este resultado nos indica que el valor de la entalpía es el mismo antes y después del proceso de estrangulamiento. Sin embargo como el proceso es irreversible, y por consiguiente no se conocen los estados intermedios, no se puede decir que la transformación se realice a entalpía constante. Es entonces conveniente aclarar que el proceso de Joule-Thomson no es una transformación isoentálpica, entendiéndose por transformación isoentálpica el lugar geométrico de todos los puntos que representan “estados de equilibrio” de la misma entalpía. No obstante, como la entalpía es una función de estado, en un proceso de estrangulamiento entre dos estados, se cumple que ΔH = 0 y si la transformación es elemental, dH = 0.
a. Se pueden referir a él
otras propiedades termodinámicas, que pueden evaluarse a partir de este efecto,
como: volúmenes específicos, calores específicos y temperaturas.
b. El resultado de la
estrangulación, en ciertas condiciones, es una reducción en la temperatura del
fluido, de forma que podemos tener un enfriamiento mediante un sistema sin
partes móviles. De hecho, bajo condiciones adecuadas, es posible que uno o más
componentes de una corriente fluida pase a la fase líquida durante el proceso
de estrangulación, de forma que puede utilizarse el sistema para proceder a la
separación de componentes de una mezcla gaseosa.
Coeficiente de Joule-Thomson.
Si hacemos H=f(P,T), como la entalpía es una función de estado, en un proceso elemental se cumple:
En un proceso de Joule-Thomson: dH=0 por lo tanto:
Haciendo pasaje de términos e indicando con el subíndice H que en el proceso la entalpía inicial y final es la misma:
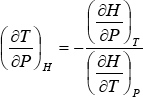
La cantidad 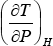 , que representa la variación de la temperatura con la presión en un proceso de Loule-Thomson, se denomina “coeficiente de Joule-Thomson” y se lo simboliza con la letra μ. Como en la ecuación anterior
, que representa la variación de la temperatura con la presión en un proceso de Loule-Thomson, se denomina “coeficiente de Joule-Thomson” y se lo simboliza con la letra μ. Como en la ecuación anterior 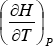 es igual a CP, nos queda finalmente:
es igual a CP, nos queda finalmente:
Como H=U + P.V la expresión puede también tomar la forma:
Que nos da una ecuación completamente general, aplicable a cualquier gas.
En el caso particular de un gas ideal, se cumple que:
en consecuencia, como CP ≠ 0 resulta μ =0
Que nos indica que si un gas ideal sufre un estrangulamiento, su temperatura varía, pues:


No hay comentarios:
Publicar un comentario