La ley de Raoult fue
propuesta por el químico francés François-Marie Raoult en 1887, y sirve para
explicar el comportamiento de la presión de vapor de una solución de dos
sustancias miscibles (típicamente ideal) en función a la presión parcial de
vapor de cada componente presente en esta.
La ley de Raoult fue
propuesta por el químico francés François-Marie Raoult en 1887, y sirve para
explicar el comportamiento de la presión de vapor de una solución de dos
sustancias miscibles (típicamente ideal) en función a la presión parcial de
vapor de cada componente presente en esta.
Existen leyes de la química que se
utilizan para describir el comportamiento de sustancias en diferentes
condiciones y explicar los fenómenos en los que se encuentran involucrados,
haciendo uso de modelos matemáticos científicamente demostrados. La ley de
Raoult es una de estas.
Usando una explicación basada en las interacciones entre las moléculas
de los gases (o líquidos) para predecir el comportamiento de las presiones de
vapor, esta ley usarse para estudiar soluciones no-ideales o reales, siempre
que se consideren los coeficientes necesarios para corregir el modelo
matemático y ajustarlo a condiciones no-ideales.
¿En qué consiste?
La ley de Raoult está fundamentada en
la suposición de que las soluciones involucradas se comportan de manera ideal:
esto ocurre porque esta ley está basada en la idea de que las fuerzas
intermoleculares entre moléculas distintas son iguales a las que existen entre
moléculas similares (lo cual no es tan acertado en la realidad).
De hecho, mientras más se acerque a la
idealidad una solución, más oportunidad tendrá de cumplir con las
características que propone esta ley.
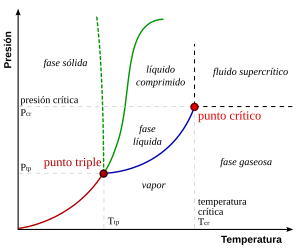
Esta ley relaciona la presión de vapor
de una solución con un soluto no-volátil, enunciando que esta será igual a la
presión de vapor de ese soluto puro a esa temperatura, multiplicada por la
fracción molar del mismo. Esto se expresa en términos matemáticos para un solo
componente de la siguiente forma:
Pi = Pºi .
Xi
En esta expresión Pi es
igual a la presión parcial de vapor del componente i en la mezcla gaseosa, Pºi es
la presión de vapor del componente puro i, y Xi es la fracción
molar del componente i en la mezcla.
De la misma forma,
cuando se tengan varios componentes en una solución y estos hayan alcanzado un
estado de equilibrio, se puede calcular la presión total de vapor de la
solución por combinación de la ley de Raoult con la de Dalton:
P = PºAXA +
PºBXB + PºCXc …
Asimismo, en aquellas
soluciones donde únicamente están presentes un soluto y el solvente, se puede
formular la ley como se ve a continuación:
PA =
(1-XB) x PºA
Desviaciones positivas y
negativas
Las soluciones que
pueden ser estudiadas con esta ley normalmente deben comportarse de manera ideal,
ya que las interacciones entre sus moléculas son pequeñas y permiten que se
asuman las mismas propiedades a través de toda la solución sin excepción.
Sin embargo, las
soluciones ideales son prácticamente inexistentes en la realidad, por lo que se
deben incorporar dos coeficientes a los cálculos que representan las
interacciones intermoleculares. Estos son el coeficiente de fugacidad y el
coeficiente de actividades.
En este sentido, las
desviaciones con respecto a ley de Raoult se definen como positivas o
negativas, dependiendo de los resultados obtenidos en el momento.
·
Desviaciones positivas
Las desviaciones
positivas con respecto a la ley de Raoult ocurren cuando la presión de vapor de
la solución es mayor a la que se calculó con la ley de Raoult.
Esto sucede cuando las
fuerzas de cohesión entre las moléculas similares son mayores a las mismas
fuerzas entre moléculas distintas. En este caso, ambos componentes se vaporizan
de manera más sencilla.
Esta desviación se
aprecia en la curva de presión de vapor como un punto máximo en una composición
en particular, formando un azeótropo positivo.
El azeótropo es una
mezcla líquida de dos o más compuestos químicos que se comporta como si
estuviera formada por un solo componente y que evapora sin cambiar de composición.
·
Desviaciones negativas
Las desviaciones
negativas respecto a la ley de Raoult se presentan cuando la presión de vapor
de la mezcla es menor a la esperada tras el cálculo con la ley.
Estas desviaciones
aparecen cuando las fuerzas de cohesión entre las moléculas de la mezcla son
mayores a la media de fuerzas entre las partículas de los líquidos en su estado
puro.
Este tipo de desviación
genera una retención de cada componente en su estado líquido por fuerzas
atractivas mayores a las de la sustancia en estado puro, por lo que la presión
parcial de vapor del sistema se ve reducida.
Los azeótropos negativos
en las curvas de presión de vapor representan un punto mínimo, y demuestran una
afinidad entre los dos o más componentes involucrados en la mezcla.